Especialistas em Diagnóstico e Análise de Imagens Médicas .Técnicas e melhores práticas para profissionais de saúde. Aprenda com especialistas. Diagnóstico e Análise de Imagens são pilares da prática clínica moderna: as imagens médicas orientam decisões de rastreamento, triagem e acompanhamento terapêutico, impactando diretamente a segurança e o manejo dos pacientes.
A transição para sistemas digitais elevou a precisão dos exames e, em várias modalidades, contribuiu para a redução de dose quando combinada a protocolos otimizados. Os avanços em reconstrução 3D e em equipamentos portáteis ampliam o acesso aos exames e a eficiência dos fluxos de trabalho clínicos.
Modalidades como radiografia, ultrassom, tomografia e ressonância compõem um ecossistema técnico integrado; a escolha adequada da técnica depende da suspeita clínica, disponibilidade e risco/benefício para o paciente.
A integração de inteligência artificial e de processamento avançado já melhora sensibilidade e consistência na detecção de sinais sutis, padronizando fluxos e acelerando interpretações — um ganho relevante para a saúde pública e para resultados clínicos.
Este artigo é um guia prático que conecta teoria e aplicação: orienta sobre aquisição, processamento, controle de qualidade e adoção responsável de novas tecnologias, oferecendo recomendações úteis para radiologistas, tecnólogos e gestores. (Próximo passo: ao final do artigo há um checklist prático para auditar seus protocolos.)
Como usar este guia de How-To para melhorar precisão, eficiência e qualidade
Use este manual como um roteiro prático para integrar protocolos, equipamentos e fluxos de trabalho em serviços de diagnóstico por imagem. O foco é apresentar ações rápidas e mensuráveis que aumentam a eficiência, reduzem retrabalho e elevam a qualidade do diagnóstico, desde a escolha da modalidade até a entrega do laudo.
Planejamento
Monte um plano de melhoria contínua com metas claras e KPIs (por exemplo: tempo agendamento→laudo, taxa de retrabalho, dose média por protocolo). Priorize mudanças de alto impacto e baixo esforço — padronização de protocolos digitais, calibração de detectores e checklists operacionais costumam gerar ganhos rápidos.
Pilotos e uso de IA
Implemente recursos de inteligência artificial de forma incremental: comece por pilotos controlados em áreas de alto volume (triagem mamográfica, priorização de tórax) e avalie sensibilidade/especificidade localmente antes da adoção plena.
Segurança de dados e governança
Alinhe novas ferramentas às normas de proteção de dados, auditoria e segurança para proteger pacientes e garantir rastreabilidade. Use logs do PACS/RIS para extrair métricas operacionais e medir impacto dos pilotos.
- Passo 1 — Mapear gargalos do agendamento à entrega do laudo e definir responsáveis.
- Passo 2 — Definir KPIs e metas (tempo médio de laudo, taxa de revisita, dose por protocolo).
- Passo 3 — Rodar pilotos de IA com validação local e monitoramento contínuo de performance.
- Passo 4 — Escalar mudanças bem-sucedidas e treinar equipes multidisciplinares.
Treine equipes e documente resultados: esse ciclo de melhoria consolida a inovação, melhora processos e assegura retorno clínico e operacional. (Recomendação prática: ao final do artigo há um template de plano de melhoria contínua para download.)
Fundamentos do Diagnóstico por Imagem na prática clínica
Escolher a modalidade adequada exige relacionar a suspeita clínica com riscos, tempo, disponibilidade e impacto no manejo. O objetivo é obter informação que realmente altere decisões terapêuticas com rapidez e precisão.
Quando indicar cada modalidade
Radiografia — indicada para avaliação inicial de fraturas, triagem torácica e situações de emergência; vantagem: rapidez e baixo custo; limitação: menor sensibilidade para lesões sutis.
Ultrassonografia — primeira linha em abdome, pélvis, tireoide e pediatria; versátil, em tempo real e sem radiação, útil também para guia de procedimentos e avaliação Doppler.
Tomografia — fornece cortes seccionais e reconstruções 3D, indicada quando são necessários detalhes anatômicos e avaliação vascular/trauma; exigir otimização de dose é fundamental.
Ressonância — preferência para diferenciação tecidual (SNC, músculo‑esquelético, fígado), sem radiação ionizante; excelente para caracterização de lesões e planejamento cirúrgico.
Medicina nuclear / PET‑CT — complementar quando se precisa de informação funcional ou metabólica, especialmente em oncologia; aumenta sensibilidade na detecção precoce de atividade tumoral. DXA e mamografia mantêm papeis definidos em rastreio e prevenção.
Integração entre achados e tratamento centrado no paciente
A integração de laudo imagiológico com comorbidades, idade, gestação e logística clínica permite decisões custo‑efetivas e seguras para os pacientes. Use protocolos clínicos e checklists para garantir pertinência do exame ao problema tratado.
- Defina plano de cortes e uso de contraste conforme hipótese clínica (trauma, oncologia, vascular).
- Adote protocolos anatômicos padronizados para reduzir variações e aumentar reprodutibilidade dos exames.
- Garanta comunicação objetiva entre clínica e radiologia; utilize checklists no pedido do exame para reduzir retrabalho.
A tecnologia serve ao cuidado: escolha a modalidade que maximize precisão diagnóstica e impacto no tratamento do paciente. (Sugestão prática: incluir um fluxograma de escolha de modalidade como recurso complementar ao artigo.)
Radiografia e Mamografia: bases, qualidade de imagem e rastreamento
As técnicas de raio‑X e mamografia evoluíram para priorizar dose reduzida e maior nitidez. A radiografia continua indicada para fraturas, avaliação torácica e triagens rápidas; parâmetros como kVp, mAs e distância foco‑filme influenciam contraste e dose, portanto devem ser monitorados no controle de qualidade.
Os sistemas digitais melhoraram a relação sinal‑ruído (SNR), reduziram doses quando combinados com protocolos otimizados e aceleraram o fluxo de trabalho. Correções de ganho e offset em detectores planos estabilizam a eficiência detective (DQE) e diminuem artefatos fixos — termos técnicos que vale explicar em um glossário para equipes.
Raio‑X: indicações, dose e evolução
O técnico deve checar foco, grade e selecionar AEC quando disponível. Ajustes apropriados preservam resolução enquanto controlam ruído; monitore métricas de rotina (SNR, ruído e MTF) para manter qualidade consistente.
Mamografia digital e tomossíntese
Mamografia digital é padrão para rastreio, melhorando a detecção de microcalcificações e o conforto da paciente; em mamas densas, a sensibilidade tende a aumentar com técnicas complementares.
Tomossíntese fornece cortes 3D que reduzem sobreposição de tecido e podem diminuir a necessidade de exames complementares. Estudos comparativos sugerem que, com protocolos adequados, é possível manter ou reduzir dose enquanto melhora a taxa de detecção — referenciar literatura local é recomendado antes da adoção.
Boas práticas de aquisição para reduzir ruído e manter resolução
Compressão adequada, controle de movimento e verificação de foco elevam a qualidade perceptual. Há um equilíbrio entre suavização e preservação de bordas, essencial em tarefas de detecção de microcalcificações.
“A qualidade perceptual depende de resolução e ruído; o pós‑processamento deve realçar microdetalhes sem amplificar artefatos.”
| AspectoRaio‑X digitalMamografia digital / Tomossíntese | ||
| Indicações | Fraturas, tórax, triagem | Rastreamento mamário, avaliação de nódulos |
| Parâmetros-chave | kVp, mAs, DFF | Compressão, AEC, alinhamento |
| Vantagens | Menor dose, melhor SNR | Melhor detecção de microcalcificações; 3D reduz sobreposição |
| Controle de qualidade | MTF, medição de ruído, correções ganho/offset | MTF específico, teste de contraste, verificação de artefatos |
Pós‑processamento: técnicas como equalização adaptativa, filtros de Wiener e transformada wavelet podem melhorar contraste local sem comprometer medidas quantitativas; valide algoritmos com tarefas clínicas específicas antes de padronizar uso em rotina.
- Padronize protocolos e treine tecnólogos para checar parâmetros críticos — um checklist QA reduz variabilidade.
- Monitore métricas de qualidade (SNR, MTF, dose média por protocolo) e registre tendências para auditoria.
- Encaminhe para ultrassom ou biópsia conforme BI‑RADS e achados suspeitos; documente a indicação no laudo para rastreabilidade.
Ultrassonografia na rotina: versatilidade, Doppler e aplicações em tempo real
Ultrassonografia é uma ferramenta essencial no diagnóstico por imagem — portátil, sem radiação e capaz de fornecer informações anatômicas e funcionais em tempo real. Sua versatilidade a torna indicada para triagem, diagnóstico e guia de procedimentos, contribuindo para melhoria da eficiência e do cuidado aos pacientes.
Quando usar: ultrassom é primeira linha em abdome agudo, avaliação pélvica/obstétrica, tireoide e pediatria; também é a opção preferida para estudos vasculares com Doppler e para procedimentos guiados por imagem.
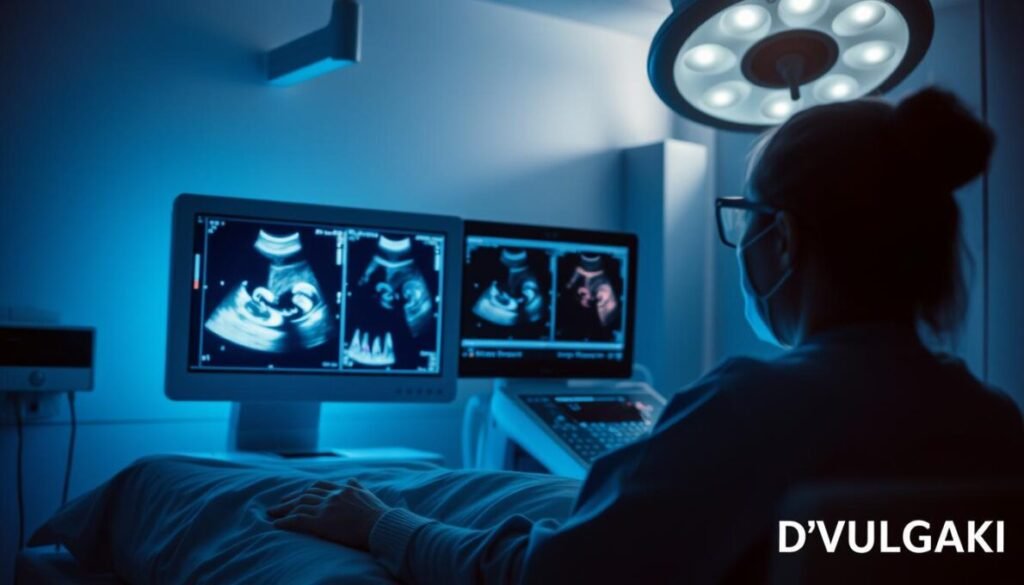
O Doppler colorido e espectral oferece parâmetros hemodinâmicos (fluxo, velocidades, índices) essenciais na avaliação de tromboses, estenoses e no seguimento de enxertos, melhorando a acurácia do diagnóstico.
Configurações práticas — ganho, profundidade, foco, harmônicos e compounding — devem ser ajustadas conforme biotipo e alvo para equilibrar penetração e resolução. Use presets por órgão para reduzir variação operadora e exames inconclusivos.
3D/4D amplia a avaliação volumétrica, especialmente em obstetrícia e mapeamento de lesões superficiais; contudo, quando o estadiamento ou planejamento cirúrgico exigir alta resolução anatômica, correlacione com TC/RM.
“Portabilidade viabiliza decisões rápidas no ponto de cuidado, especialmente em emergência e UTI.”
- Protocolos por órgão: defina janelas, posicionamento e presets para cada tipo de exame.
- Mitigue artefatos comuns (reverberação, sombra acústica, anisotropia) com ajustes em tempo real e técnica adequada.
- Registre medidas e imagens-chave para comparação longitudinal e auditoria de qualidade.
- Checklist pré-exame: informe preparo (jejum, bexiga cheia quando indicado), confirme identificação e histórico relevante para otimizar a qualidade do exame.
Tomografia Computadorizada e Ressonância Magnética: como obter imagens de alta precisão
TC e RM são essenciais para obter imagens de alta fidelidade; protocolos alinhados ao caso clínico garantem precisão diagnóstica e melhoram resultados clínicos. A TC combina raios‑X e processamento para cortes finos e reconstruções 3D úteis no planejamento cirúrgico e emergência, enquanto a RM oferece excelente contraste tecidual sem radiação ionizante.
TC: reconstruções, contraste e otimização de dose
Otimização de dose (prática): aplique modulação de corrente (mAs), ajuste de kVp por biotipo, colimação adequada e pitch correto; adote algoritmos iterativos de reconstrução para reduzir ruído mantendo resolução. Exemplos práticos: para tórax em adulto use faixas típicas de 100–120 kVp com modulação automática de corrente; para abdome-pélvis, ajuste kVp/mAs conforme IMC e prefira reconstrução iterativa para reduzir dose efetiva — sempre documente e compare com benchmarks locais.
Uso de contraste iodado destaca vasos e lesões; implemente checklist pré‑exame para verificar função renal (eGFR) e histórico de alergias, e registre consentimento quando necessário.
RM: protocolos para SNC, músculo‑esquelético e abdome
RM usa campos magnéticos e sequências específicas para caracterização tecidual. Para SNC, inclua rotinas T1, T2, FLAIR e DWI; para músculo‑esquelético combine T1, T2 e supressão de gordura (STIR/PD), e para abdome integre difusão e fases pós‑contraste quando indicado.
Sequências aceleradas (parallel imaging, compressed sensing) e técnicas de redução de movimento (triggering, bandas de saturação) reduzem tempo do exame e melhoram conforto do paciente, sem comprometer a qualidade diagnóstica.
“Sequências aceleradas e técnicas de supressão de movimento melhoram conforto e reduzem tempo de exame.”
- Prefira RM em pacientes jovens quando possível e em avaliação detalhada de tecidos moles.
- Checklist pré‑exame: confirmar função renal, alergias, presença de dispositivos implantáveis e histórico relevante.
- Audite imagens e laudos com métricas objetivas (p.ex. SNR, MTF para protocolos TC/RM) e laudos estruturados para manter consistência.
| AspectoTCRM | ||
| Princípio | Raios‑X + reconstrução (cortes finos, 3D) | Campo magnético + radiofrequência (contraste tecidual) |
| Contraste | Iodado (vascular/lesões); verifique eGFR | Gadolínio (pós‑contraste funcional); avaliar risco e função renal |
| Otimização | kVp/mAs modulado, colimação, reconstrução iterativa | Paralelização, compressed sensing, sequências rápidas |
| Indicação preferencial | Trauma, avaliação óssea/vascular, planejamento cirúrgico | SNC, músculo‑esquelético, avaliação funcional/tecidual |
Registre parâmetros de aquisição e doses por protocolo em painel de indicadores para monitoramento contínuo. (Sugestão prática: disponibilize uma planilha de monitoramento de dose média por protocolo e revise resultados trimestralmente.)
Medicina Nuclear e PET-CT: análise funcional e detecção precoce
Medicina nuclear emprega radiofármacos para mapear função e metabolismo celular; o PET‑CT agrega informação funcional e anatômica, sendo referência para estadiamento, reestadiamento e avaliação de resposta terapêutica em oncologia.
Indicações e quando recorrer
Quando recorrer: utilize cintilografia ou PET‑CT para complementar imagem anatômica quando a informação funcional for determinante — por exemplo, estadiamento oncológico, avaliação de resposta precoce e determinação de sítio para biópsia. Isso aumenta a precisão do diagnóstico e reduz o risco de subestimar a extensão tumoral.
Preparo e protocolo
Padronize o preparo do paciente: jejum adequado, controle de glicemia (especialmente em PET‑FDG), hidratação e tempo de uptake padronizado. Variáveis não controladas comprometem a reprodutibilidade e a comparabilidade seriada dos resultados.
Interpretação quantitativa
Inclua medidas quantitativas (SUV, volumes metabólicos) no laudo para avaliar resposta objetiva ao tratamento. Correlacione sempre os achados funcionais com TC/RM e o contexto clínico para reduzir falsos positivos por processos inflamatórios.
- Checklist pré‑exame (ex.: jejum, glicemia, medicações, tempo de uptake) para technologists.
- Integre SUV e parâmetros quantitativos padronizados ao laudo e registre condições de aquisição.
- Avalie PET também em cardiologia e neurologia quando a informação funcional puder alterar o manejo.
“Radiofármacos específicos e detectores mais sensíveis ampliam precisão e reduzem tempo de exame.”
| AspectoPET‑CTCintilografia | ||
| Indicação típica | Oncologia: estadiamento e resposta | Função orgânica: tireoide, ossos, rins |
| Fornece | Metabolismo + anatomia | Mapeamento funcional regional |
| Limitações | Falsos positivos inflamatórios; custo | Menor resolução espacial |
| Logística | Radiofármacos controlados; sala dedicada | Radiofármacos e tempo de aquisição variados |
Segurança e logística
Segurança: siga protocolos para administração, transporte e descarte de radiofármacos; registre doses e monitore exposição da equipe. Atenda às normas locais e às boas práticas (ex.: orientação EANM/PERCIST quando aplicável) para garantir qualidade e conformidade.
Por fim, pese custo versus impacto clínico: os avanços em radiofármacos e detectores podem ampliar o benefício diagnóstico e influenciar positivamente desfechos em saúde, mas a adoção deve ser baseada em avaliação de custo‑efetividade e validação local.
Densitometria Óssea e Angiografia: quando e como aplicar
DXA (densitometria óssea) mensura a densidade mineral com baixa dose e é ferramenta-chave para diagnosticar osteopenia e osteoporose. Indique DXA em pacientes com fatores de risco: idosos, mulheres pós‑menopausa, uso crônico de corticoides ou histórico de fraturas fragilidade.
Padronize regiões de análise: coluna lombar, fêmur proximal e antebraço. A preparação é simples, mas a repetibilidade exige protocolo fixo e registro das condições (posicionamento, equipamento, software). Recomenda-se reavaliar conforme risco (por exemplo, a cada 1–2 anos em pacientes de alto risco; seguem diretrizes locais para intervalos específicos).
Interpretação: utilize T‑score para decisões terapêuticas em adultos e Z‑score em populações pediátricas ou casos secundários. O laudo deve integrar risco de fratura e recomendações clínicas (farmacológicas e não‑farmacológicas) para suporte ao tratamento.
Angiografia: indicação e opções
A angiografia permite visualização direta de vasos com contraste e orienta intervenções (stent, angioplastia). A angiografia digital subtraída aumenta a qualidade da imagem vascular e reduz artefatos, facilitando procedimentos endovasculares.
- Escolha entre angio‑RX (angiografia convencional), angio‑TC ou angio‑RM conforme a pergunta clínica e função renal: se eGFR < 30 mL/min/1,73m2, priorize técnicas sem contraste iodado (angio‑RM quando possível) ou alternativas não contrastadas.
- Cuidados pré‑procedimento: avaliar acesso vascular, função renal, alergias e anticoagulação; orientar hidratação quando indicado.
- Cuidados pós‑procedimento: checar hemostasia, monitorar função renal e sinais de complicação; registrar doses de contraste e detalhes do procedimento no laudo.
“Tecnologias bem aplicadas reduzem complicações e melhoram desfechos em saúde.”
Integre o laudo com recomendações de seguimento e medidas preventivas individualizadas. Fluxos ágeis entre atenção básica, cardiologia/vascular e radiologia intervencionista elevam qualidade do cuidado e otimizam o uso de recursos.
Diagnóstico e Análise de Imagens orientados por processamento digital
Um fluxo de processamento bem definido é peça-chave para transformar imagens brutas em informação clínica útil. Inicie o pipeline garantindo correção de ganho/offset para estabilizar a eficiência detectora (DQE) em detectores planos e documente esses passos para rastreabilidade.

Pré-processamento e equalização
O pipeline básico inclui: correção de ganho/offset, normalização de intensidade, remoção de ruído e equalização adaptativa de histograma. A equalização adaptativa realça contraste local sem saturar áreas brilhantes — útil em tórax digital e mamografia — mas valide sempre o efeito sobre medidas quantitativas antes de padronizar.
Redução de ruído, wavelets e métricas
Filtros (ex.: Wiener) e transformações estabilizadoras (Anscombe para ruído Poisson) reduzem ruído preservando bordas; wavelets oferecem realce multiescala e compressão eficiente. Use métricas objetivas (SNR, MTF, NPS) para quantificar impacto das operações de processamento sobre a capacidade de detecção.
“Realces bem calibrados aumentam detectabilidade sem criar artefatos que confundem leitores.”
| EtapaObjetivoQuando aplicar | ||
| Ganho/Offset | Estabilizar DQE | Detectores planos, rotina diária |
| Equalização adaptativa | Melhorar contraste local | Tórax, mamografia |
| Wiener / Anscombe | Redução de ruído preservando bordas | Imagens com baixo SNR |
| Wavelets | Realce multiescala | Microcalcificações e bordas finas |
Parâmetros recomendados (exemplos) e validação
Para cada tarefa (detecção de nódulos, microcalcificações, acompanhamento volumétrico) defina parâmetros-alvo e valide com estudos orientados à tarefa. Exemplos: medir SNR antes/depois do filtro; comparar MTF com phantom; testar detectabilidade em conjuntos anotados. Documente versões de algoritmo, parâmetros e resultados de validação.
Integração com PACS/RIS e governança de dados
Integre o processamento digital ao PACS e às estações de leitura para garantir reprodutibilidade e rastreabilidade dos dados. Registre logs padronizados (parâmetros, versão do algoritmo, timestamp) e mantenha políticas de governança para auditar desempenho e proteger dados clínicos.
Adote práticas de desenvolvimento e validação que permitam acompanhar inovações tecnológicas e o desenvolvimento de ferramentas assistidas por IA, sempre avaliando impacto sobre a qualidade e a precisão do diagnóstico.
Segmentação e extração de características para decisão clínica
A segmentação precisa transforma imagens brutas em medidas quantitativas que suportam decisões clínicas objetivas. Combinar métodos clássicos, modelos baseados em contornos e descritores de textura‑morfologia gera métricas confiáveis para laudos e acompanhamento longitudinal.
Técnicas clássicas e indicação prática
Crescimento de região é eficaz quando há homogeneidade interna (ex.: órgãos com contraste consistente); defina thresholds iniciais e limite de intensidade para evitar vazamentos.
Watershed separa estruturas adjacentes por relevos de intensidade — útil para lesões próximas a vasos desde que pré‑processamento reduza ruído.
Detecção de bordas (Canny) destaca limites finos e serve como etapa inicial para refinar máscaras e melhorar precisão da segmentação.
Level sets e modelos estatísticos
Level sets e modelos ativos acompanham gradientes e são robustos em contornos complexos (ex.: fígado, tumores em TC). Modelos estatísticos de forma (shape models) reduzem variabilidade 3D entre pacientes e melhoram consistência de medidas volumétricas.
Textura, morfologia e validação
Extraia features de intensidade, forma e textura (GLCM / Haralick, histogramas, momentos geométricos) para alimentar classificadores e prever prognóstico ou resposta ao tratamento.
“A qualidade da segmentação determina a acurácia de medidas volumétricas e reconstruções 3D.”
| MétodoForçaLimitaçãoAplicações típicas | |||
| Crescimento de região | Rápido, simples | Sensível a ruído e variações de intensidade | Órgãos homogêneos |
| Watershed | Separa estruturas adjacentes | Over‑segmentation sem pré‑processamento | Lesões próximas a vasos |
| Canny (bordas) | Detecção de limites finos | Requer pós‑processamento para máscaras | Contornos precisos |
| Level sets / contornos ativos | Robusto em contornos complexos | Computacionalmente mais caro | Fígado, tumores |
| Modelos estatísticos | Reduz variabilidade entre pacientes | Necessita base de treinamento | Reconstruções 3D consistentes |
- Valide segmentações com métricas (Dice, Hausdorff) contra referências expert e use conjuntos de dados públicos para benchmarking.
- Defina fluxos semiautomáticos com revisão humana: p.ex., algoritmo → revisão por tecnólogo → correção por radiologista; registre tempo e alterações para auditoria.
- Inclua exemplos numéricos de parâmetros (ex.: seed threshold inicial, tamanho mínimo de máscara) nos protocolos locais e documente resultados de testes de sensibilidade.
Para desenvolvimento progressivo, priorize regiões de maior impacto clínico, acompanhe desempenho longitudinalmente e mantenha um repositório de casos anotados para validação contínua. (CTA sugerido: link para repositório de datasets e protocolo de validação local.)
Inteligência Artificial na análise de imagens médicas no Brasil
Ferramentas baseadas em aprendizado de máquina já são empregadas para priorizar listas de trabalho e acelerar triagem em serviços com alta demanda, contribuindo para redução do tempo até o laudo e melhor uso de recursos humanos.

CAD e aprendizado de máquina: do rastreio mamográfico à estratificação de risco
O CAD (computer-aided detection) em mamografia evoluiu para modelos treinados em grandes bases de imagens; no entanto, o ganho real depende da qualidade dos dados, das variabilidades de aquisição e do protocolo de leitura. Modelos modernos combinam imagens com dados clínicos para estratificar risco e orientar seguimento, melhorando a precisão diagnóstica em processos bem validados.
Fluxos assistidos por inteligência artificial: triagem, detecção e priorização
No Brasil, soluções comerciais e projetos acadêmicos são usados para ordenar filas, destacar exames suspeitos e reduzir tempos de resposta. Integrações com PACS/RIS permitem alertas e dupla leitura, mas a supervisão humana deve permanecer como padrão para decisões finais.
Governança, privacidade e qualidade de dados
Boas práticas incluem anonimização, consentimento quando aplicável, auditoria contínua de performance e validação local antes da adoção em rotina clínica. Observe regulamentação local (ANVISA, LGPD) e documente processos de validação e monitoramento.
“Valide algoritmos em bases locais; a variabilidade de aquisição altera sensibilidade e especificidade.”
Checklist para validar um algoritmo localmente (prático)
- Defina a tarefa clínica e o KPI alvo (sensibilidade, especificidade, tempo de priorização).
- Reúna uma base local representativa e anote condições de aquisição (equipamento, protocolo, população).
- Avalie performance inicial (ROC, AUC, sensibilidade/especificidade) e compare com referência humana.
- Implemente um piloto controlado, monitore false positives/negatives e taxa de reconvocação.
- Estabeleça plano de governança: logs, versions, auditoria contínua e política de rollback.
Monitore continuamente sensibilidade, especificidade, tempo de resposta e taxa de reconvocação; implemente salvaguardas para evitar dependência cega e promova transparência algorítmica (explicabilidade) sempre que possível.
Para escalar, siga um roadmap: piloto → validação local → integração ao PACS/RIS → monitoramento em produção e atualização contínua com novos dados. Essa abordagem garante que o uso da IA traga benefícios reais à análise de imagens e ao diagnóstico, sem comprometer segurança ou qualidade dos cuidados.
Como implementar um fluxo de trabalho de imagem eficiente e seguro
Organizar fluxos claros entre solicitação e laudo reduz erros operacionais, acelera entregas e melhora a qualidade do diagnóstico. Tecnologias modernas (PACS/RIS, estações de pós‑processamento e ferramentas de IA) otimizam exames e permitem monitoramento contínuo, desde que haja supervisão humana e governança de dados eficaz.
Integração PACS/RIS, protocolos padronizados e controle de qualidade
Mapeie todas as etapas do pedido ao resultado, definindo responsáveis, pontos de checagem e SLA. Garanta interoperabilidade usando padrões (DICOM, HL7) e integre PACS/RIS a ferramentas de pós‑processamento para rastreabilidade dos dados e saída padronizada de laudos.
Implemente um programa de QA com testes periódicos (MTF, uniformidade, ruído, SNR) e revisão por pares; mantenha registros das calibrações, versões de software e parâmetros de aquisição para auditoria.
Roadmap operacional e responsabilidades (exemplo 90 dias)
- 0–30 dias: mapear fluxo pedido→laudo e identificar gargalos; nomear responsáveis por cada etapa.
- 30–60 dias: padronizar protocolos por modalidade e implementar checklists pré‑exame; configurar integração PACS/RIS e backups.
- 60–90 dias: rodar auditoria inicial de QA, ajustar protocolos com base em KPIs e treinar equipes.
Indicadores-chave: precisão diagnóstica, tempo de resposta e dose
Defina KPIs claros e metas mensuráveis (exemplos): tempo médio pedido→laudo < 48 horas; taxa de retrabalho < 5%; dose média por protocolo dentro de benchmarks locais. Monitore precisão diagnóstica via auditoria de casos e use IA para priorizar casos críticos, sempre avaliando impacto na carga de trabalho e na qualidade do atendimento.
“Governança de dados, backups e planos de continuidade sustentam segurança e qualidade.”
| AspectoSoluçãoBenefício | ||
| Fluxo pedido‑laudo | Mapeamento, SLAs e checklists | Menos retrabalho; maior eficiência |
| Integração | PACS/RIS + pós‑processamento (DICOM/HL7) | Rastreabilidade dos dados; laudos padronizados |
| Controle de qualidade | Testes periódicos, revisão por pares | Consistência diagnóstica e melhoria contínua |
| Indicadores | KPI: acurácia, tempo, dose | Decisões gerenciais baseadas em métricas |
Recomendações práticas: mantenha um dashboard de KPIs acessível às equipes, realize reuniões quinzenais para revisar indicadores e tenha um plano de continuidade (backups, redundância de servidores, procedimentos de recuperação). Disponibilize templates de mapeamento de fluxo e checklist QA para apoio à implementação.
Conclusão
O uso inteligente de tecnologias e protocolos transforma resultados clínicos e operacionais. A integração eficaz entre escolha de modalidade, padronização de protocolos e a correta análise de imagens eleva a qualidade do diagnóstico, aumenta a precisão e protege os pacientes, gerando impacto mensurável na saúde.
Os avanços em portabilidade, reconstruções 3D/4D e em inteligência artificial ampliam acesso, reduzem tempos e potencializam qualidade dos resultados — desde que sejam validados localmente e integrados a fluxos com governança de dados.
Próximos passos práticos
- Curto prazo (0–3 meses): revisar e padronizar protocolos críticos; aplicar checklists QA; treinar equipes em boas práticas de aquisição.
- Médio prazo (3–9 meses): iniciar pilotos controlados de inteligência artificial, implementar painel de indicadores (tempo laudo, dose, acurácia) e ajustar protocolos com base nos KPIs.
- Longo prazo (9–18 meses): escalar tecnologias validadas, aperfeiçoar integração PACS/RIS, documentar governança de dados e promover desenvolvimento local e validação clínica contínua.
Use este artigo como roteiro: baixe os templates sugeridos (checklist QA, planilha KPIs, roadmap de piloto IA) para operacionalizar mudanças e alcançar resultados mensuráveis na prática de diagnóstico por imagens.





